Доклад проф.Николаева В.В. для ESPU-2018 об отсроченном закрытии экстрофии мочевого пузыря без остеотомии, лонной аппроксимации или перемещенных лоскутов.
Отсроченное первичное и повторное закрытие экстрофии мочевого пузыря без остеотомии, лонной аппроксимации или перемещенных лоскутов: в чем выгода?
Содержание:
Введение
Экстрофия мочевого пузыря остается одним из сложнейших состояний в детской урологической практике. Надежное закрытие мочевого пузыря и передней брюшной стенки является ключевым фактором в достижении успеха лечения недержания мочи. В то же время неуспех первичного закрытия считается ведущей причиной нарушения оптимального развития мочевого пузыря и ухудшения прогноза лечения.
Главной задачей, решаемой во время закрытия экстрофии, является устранение натяжения тканей путем мобилизации краев мочевой пластинки и их прикреплений к лонным костям.
Закрытие дефекта брюшной стенки, существующего вследствие диастаза между лонными костями, производится после сближения лонных костей с остеотомией или без нее, а также при помощи перемещенных лоскутов прямых мышц или их оболочек и кожных лоскутов.
Классический подход к закрытию экстрофии основан на сведении лонных костей с обязательным использованием остеотомии при отсроченном закрытии или без остеотомии в первые 2-3 дня после рождения.
Несмотря на большой опыт ряда хирургов в применении классического подхода, сохраняется значительная частота осложнений после закрытия, и нередко встречаются осложнения как после остеотомии, так и при аппроксимации лонных локтей без остеотомии.
В последние годы становится более популярным отсроченное закрытие мочевого пузыря. Особенно после того, как было показано, что развитие мочевого пузыря при отсроченном закрытии в первом триместре жизни не влияет отрицательно на развитие мочевого пузыря.
Отсроченное закрытие применялось в США с 2013 по 2015 гг. примерно в 2/3 случаев.
Обычно откладывание операции на более поздний срок связано с недоношенностью, малым размером мочевой пластинки или отсутствием поблизости специалистов по лечению экстрофии.
Необходимость остеотомии или сближения лонных костей при отсроченном закрытии признается сегодня многими авторами в качестве метода, увеличивающего надежность закрытия, особенно для повторных закрытий, при большом диастазе лонных костей.
Вместе с тем, необходимость длительной иммобилизации, высокая стоимость лечения, увеличение травматичности операций, высокий риск гемотрансфузии, трудности ухода за ребенком делают процедуру остеотомии не очень привлекательной.
Кроме того, редиастаз возникает у всех детей как после остеотомии, так и после аппроксимации лона без остеотомии, что снижает ценность сведения костей лона как метода лечения недержания мочи.
Недостатки аппроксимации лонных костей являются поводом для альтернативных предложений более полувека. Мнения о нецелесообразности применения остеотомии для большинства случаев с малым и средним диастазом лонных костей высказывались еще в 70-е годы Marshall Mueke и Willson Keeton. Авторы указывали на сложность и недостаточную эффективность остеотомии для стойкого устранения межлонного диастаза и лечения недержания. Дефект между лонными костями они закрывали, используя лоскуты оболочек прямых мышц живота и кожно-подкожножировые лоскуты. Аналогичную технику использовал J.Kelly (1995 г.).
Цель
В настоящей статье, вероятно, впервые представлен подход к отсроченному первичному и повторному закрытию экстрофии без остеотомии, аппроксимации лона и перемещенных лоскутов.
Исследование показывает, что рациональное упрощение техники операций не снижает надежность закрытия, позволяя в то же время избежать многих проблем послеоперационного периода.
Материалы и методы
Из 196 экстрофий, находившихся под нашим наблюдением в Российской детской клинической больнице с 1990 по 2017 гг., были отобраны 36 пациентов с классической экстрофией, которым выполнялось отсроченное закрытие экстрофии – первичное (25) и вторичное (11) после неудач первичного закрытия в других клиниках.
Все реконструкции проводились без остеотомии, сведения лона и использования перемещенных лоскутов в возрасте от 34 дней до 15 лет в период между 2004 и 2016 гг. Клоакальные и редкие аномалии являлись критериями исключения. Все дети в послеоперационном периоде регулярно наблюдались в клинике.
Техника операции
Мочепузырную пластинку отсекали от брюшной стенки и лонных костей до уровня уретральной пластинки по классической методике. Брюшину отделяли от верхушки пузыря, чтобы погрузить его вглубь таза.
Устранение боковой тракции тканей уретры путем отделения ножек члена и клитора от вертикальных ветвей лонных костей проводили субпериостально спереди назад вдоль нижних ветвей лонных костей почти до канала Алькока с рассечением поддерживающих связок.
Уретральную полоску формировали шириной 10-15 мм и длиной 15-20 мм с иссечением треугольников слизистой мочевого пузыря так, как это было описано Dees в модификации Culp с острым верхним углом 45-60 градусов, расположенным на 0,5 см каудальнее линии, соединяющей устья мочеточников.
Отступив на 2-3 мм кнаружи от уретральной полоски, выполняли параллельные разрезы подслизистого и мышечного слоев для большей мобильности при тубуляризации уретры.
Края уретры и мочевого пузыря сшивали 8-ми образными прерывистыми швами на катетере № 8-10 Fr с пиг-тэйлом.
Пузырь опускали вглубь таза и фиксировали 2-3 швами к нижнему краю связки между расходящимися прямыми мышцами.
Паравезикальный жир отслаивали тупо от боковых стенок таза и сшивали впереди уретры по средней линии.
Мертвые перавезикальные пространства дренировали, и дренажи далее выводили наружу на уровне spina iliaca ant.sup.
Кожу гипогастральной области вместе с подкожным жиром отделяли от мышечных оболочек до spina iliaca и сшивали по средней линии.
Рану закрывали давящей повязкой.
Цистостома и катетеры в мочеточниках не использовались. Иммобилизация не проводилась. Попутно у большинства детей было проведено паховое грыжесечение.
Послеоперационное лечение
Иммобилизация не проводилась. Компрессионную повязку снимали на 5-е сутки. Дренажи удаляли у большинства на 10-12 сутки, и уретральный катетер, кроме осложненных случаев, – на 16-21 сутки.
У 20 детей на 14-15 день выполняли уретроскопию, чтобы оценить заживление и проходимость уретры. У 16 пациентов вместо уретрального катетера оставляли стент № 5 Fr, который удаляли дома через 2-5 недель после выписки, когда моча начинала выделяться не только по стенту, но и помимо.
Особое внимание уделяли контролю раневой инфекции. Дополнительные антибиотики назначали при признаках раневой инфекции и симптоматической инфекции мочевыводящих путей.
Всем детям после года рекомендовали увеличивать физическую активность, особенно подвижные игры с мячом, танцы. Это, по нашим наблюдениям, способствует стабилизации межлонного диастаза и даже способно несколько уменьшить его в некоторых случаях.
Результаты
Отсроченное первичное и повторное закрытие было успешно проведено у всех детей в данном докладе.
Время операций составляло от 126 до 215 минут (в среднем 148 мин).
В послеоперационном периоде не было отмечено случаев пузырных спазмов, поэтому локальной анестезии, продленной вентиляции или пролонгированного назначения обезболивающих не требовалось.
С 1-2 дня начиналось кормление через рот.
Дренирование мочевого пузыря с помощью уретрального катетера не приводило к побочным эффектам.
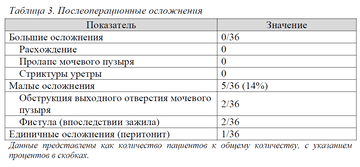
При удалении катетера у нескольких детей имелись признаки обструкции, что потребовало удлинения промежутка дренирования мочевого пузыря. У 3 из них были выполнены инцизии проксимальной уретры для восстановления пассажа мочи.
С 2013 г. цистоуретроскопия проводилась всем детям на 14-16 сутки после операции для оценки заживления уретры и смены уретрального катетера № 8-10 Fr на стент № 5 Fr. При таком ведении не наблюдались обструкции уретры, которые бы требовали дилатаций или инцизий.
В 6 наблюдениях возникла небольшая инфекция в области швов, что потребовало дополнительных антибиотиков. У 2 из них впоследствии имелась маленькая фистула, закрывшаяся самостоятельно.
У 4 детей с большим межлонным диастазом (7-8 см) были проведены остеотомии. У 3 из них одновременно с пластикой шейки мочевого пузыря.
В отдаленном периоде все дети обследовались ежегодно и проходили этапное лечение – фаллопластику, антирефлюксные операции, пластику шейки мочевого пузыря. В 3 наблюдениях были проведены повторные грыжесечения в связи с рецидивом паховой грыжи.
В промежутке между лонными костями не было видно никакого грыжевого выпячивания, что говорит о надежности закрытия дефекта образующимся плоским рубцом.
Дискуссии
Необходимость остеотомии или сближения лонных костей при отсроченном закрытии признается сегодня большинством авторов в качестве метода, увеличивающего надежность закрытия, особенно для повторных закрытий и при большом диастазе лонных костей.
Вместе с тем, увеличение травматичности и продолжительности операций, риск гемотрансфузии, длительная иммобилизации и обезболивание, имеющее побочные эффекты, высокая стоимость лечения, трудности ухода за ребенком, а также отсутствие гарантии от расхождения швов относятся к недостаткам остеотомии.
Осложнения остеотомии, не считая трансфузионного риска, по данным ведущих детских учреждений, составляет 4-7%, что позволяет опытным ортопедам рекомендовать отказ от остеотомии там, где без нее можно обойтись.
Повторный диастаз возникает у всех детей после остеотомии или аппроксимации лона без остеотомии, что снижает ценность этих процедур в лечении недержания мочи.
Операции закрытия экстрофии оцениваются хирургами как технически сложные, дорогостоящие и продолжаются в среднем 5-8 часов. Более половины детей нуждаются в переливаниях крови.
Послеоперационный период после закрытия с остеотомией проходит нелегко. Для надежного заживления считается необходимым бороться с пузырными спазмами, используя для иммобилизации больного вентиляцию или различные варианты иммобилизации, продленное обезболивание, в том числе эпидуральную анестезию.
Остеотомии имеют собственные риски осложнений, требуют длительной иммобилизации, эпидуральной анальгезии, парентерального питания, борьбы с парезом кишечника и массивного применения антибиотиков.
Дети длительно лишены грудного вскармливания, находясь в отделении интенсивной терапии, лишены контактов с матерью, что создает сильный стресс.
Таким образом, сегодня нет ответа на вопрос, поставленный J.Borer: «Дает ли остеотомия немедленные или будущие выгоды пациентам с экстрофией мочевого пузыря при выполнении ее на любом этапе лечения?»
Альтернативный метод аппроксимации лонных костей без остеотомии много лет успешно используют группы из Лондона и Регенсбурга. Сомнения у рецензентов вызывают случаи упругого таза, особенно в группе отсроченного закрытия в возрасте 6-8 недель.
Необходимость длительной иммобилизации ребенка и эпидуральной анальгезии, трудности ухода добавляют неопределенности в процесс лечения и снижают уверенность в надлежащем течении послеоперационного периода у всех пациентов.
Традиционный подход к первичному закрытию с различными вариантами остеотомии автор применял с 1994 по 2004 гг. у 23 пациентов. Редиастаз у всех детей и осложнения остеотомии (39%) заставили автора сузить показания к остеотомии.
С 2004 по 2016 закрытие экстрофии было проведено без остеотомии у 36 детей с классической экстрофией. И лишь у 2 пациентов с диастазом более 6 см были выполнены остеотомии.
Предложенный подход без аппроксимации лона, остеотомии и лоскутов оказался гораздо более легкой альтернативой, позволяя избавить детей от множества рисков, связанных с операцией, и осложнений послеоперационного периода.
Отказавшись от аппроксимации лонных костей, остеотомии, уретеральных катетеров, использования перемещенных лоскутов, мы избавились от целого ряда сложностей послеоперационного периода.
Выполнение операций после 1 месяца позволяло подготовить ребенка и выбрать время для проведения операции с учетом индивидуальных особенностей.
Технически процедура закрытия значительно упростилась и сократилась по времени.
Устранение натяжения тканей, деликатная диссекция вне зоны прохождения сосудисто-нервных пучков, погружение пузыря вглубь таза – ключевые особенности процедуры закрытия.
Несколько сложнее было закрытие после предшествующих неудач. Пузырная пластинка у нескольких детей была ригидная за счет рубцов и отека. Для вворачивания внутрь у двоих пациентов требовалось сдавление пластинки пальцами, чтобы вытеснить отечную жидкость.
Кожное закрытие по средней линии, восстановление лобка у девочек и пластика пупка были важными элементами для восстановления естественного внешнего вида.
У пациентов не было выраженных болей, и поэтому они не требовали обезболивания более 2-3 дней, эпидурального катетера и быстро возвращались к кормлению через рот. Поэтому мы не наблюдали вздутия живота, не требовался назогастральный зонд и длительное парентеральное питание.
Трансфузии проводились лишь у 4 пациентов, поступивших в наше учреждение с железодефицитной анемией.
Важно отметить отсутствие пузырных спазмов у всех наблюдаемых пациентов. Это немаловажное обстоятельство, значительно меняющее лечение в послеоперационном периоде.
По нашим наблюдениям, пузырные спазмы встречаются практически у всех новорожденных с экстрофией и представляют собой реакцию детрузора преимущественно на механическое раздражение. Можно предположить, что остеотомия и аппроксимация лона могут оказывать определенное влияние на возбудимость детрузора.
Если экстрофия закрывается в первые дни жизни, то борьба со спазмами требует применения целого арсенала мер, так как беспокойство ребенка всегда имеет негативные последствия и может привести к расхождению раны. Поэтому используется эпидуральная анестезия, вентиляция легких, холинолитики, опиоиды.
Однако, как показали наши результаты, этих немалых усилий не требуется при закрытии экстрофии после 1 месяца. К возрасту 1 месяц наступало привыкание слизистой мочепузырной пластинки к постоянному механическому воздействию подгузников, и спазмы не возникали.
Возможно, отсутствие остеотомии также играло определенную роль в уменьшении возбудимости детрузора. К этому надо добавить хорошее дренирование мочевого пузыря, благодаря уретральному катетеру с пиг-тейлом и отсутствию дополнительных дренажей в просвете пузыря.
Отсутствие иммобилизации, близкий контакт с матерью быстро успокаивали ребенка, что благоприятно влияло на течение всего послеоперационного периода.
Уретральная обструкция, по данным литературы, встречается довольно часто после закрытий экстрофии и требует повторных госпитализаций, периодической катетеризации, эндоскопических процедур и дилатаций.
Полезной находкой в настоящем исследовании для избежания рисков обструкции и симптоматической инфекции мочевыводящих путей стало оставление в уретре тонкого уретрального стента после удаления уретрального катетера. В течение 1-1,5 месяцев после операции восстанавливалась эластичность тканей уретры, и дети начинали мочиться помимо стента, что служило сигналом к его удалению. С учетом того, что многие пациенты жили вдали от больницы, это значительно упростило ведение послеоперационного периода.
Наблюдение пациентов в течение нескольких лет после операции показали, что при отсроченном закрытии без аппроксимации лона не нарушается последующий рост пузыря и проще выполнять пластику шейки, так как нет массивной рубцовой перемычки перед уретрой, которую бы приходилось рассекать и которая может быть связана с уретрой ригидным рубцовым блоком.
Данное исследование имеет определенные ограничения. Это ретроспективный анализ, и операции проводились на протяжении значительного промежутка времени. Другое ограничение заключается в отсутствии отдаленных результатов, но их обсуждение не являлось задачей настоящей статьи.
Выводы
Вероятно, это первое описание успешного отсроченного первичного и вторичного закрытия без остеотомии и лоскутов. Представленная модификация максимально упрощает процедуру закрытия, восстанавливая положение мочевого пузыря в глубине таза, не теряя при этом надежности и избегая дополнительных рисков, связанных с использованием остеотомии и анестезиологических рисков неонатального периода.
Отсутствие серьезных осложнений, минимизация затрат на лечение и возможность значительного сокращения сроков пребывания в стационаре составляют выгоды данного подхода, позволяя рассматривать его наряду с используемыми в настоящее время более сложными вариантами.
- Подпись автора
Не спрашивай, по ком звонит колокол: он звонит по тебе © (Джон Донн)