Инфекции мочевыводящих путей у детей (EAU)
Рекомендации EAU составлены по принципам «медицины, основанной на доказательствах». При создании Рекомендаций EAU использовались данные мета-анализов, размещенных в базе данных Pubmed, упоминаемые исследования классифицированы в соответствии с уровнями доказательности данных. Основная цель Рекомендаций заключается не в жестком и однозначном указании методов лечения и диагностики, а предоставление доступных современных консенсусных точек зрения на наиболее приемлемые методы ведения пациентов с урологическими нарушениями.
Уровни доказательности данных и степени рекомендаций
В данных рекомендациях от European Association of Urology упоминаемые исследования классифицированы в соответствии с уровнями доказательности данных, и каждая разработанная на их основе рекомендация отнесена в соответствующую степень (таблицы 1 и 2).
Для общего понимания рекомендуем прочитать следующие статьи:
Что такое доказательная медицина?
Уровни доказательности данных и степени рекомендаций (European Association of Urology)
Расшифровка сокращений в тексте - Cписок общепринятых сокращений в урологии
Краткий обзор и рекомендации
Инфекции мочевыводящих путей (ИМВП) являются распространенным заболеванием у детей, причем их частота развития лишь немногим ниже частоты инфекций верхних дыхательных путей и кишечных инфекций.
Заболеваемость ИМВП у детей зависит от пола и возраста. На первом году жизни, преимущественно в первые 3 мес, ИМВП чаще развиваются у мальчиков (3,7 %), чем у девочек (2 %); в дальнейшем эти показатели меняются и составляют 3 % у девочек и 1,1 % у мальчиков. ИМВП служат самой частой причиной лихорадки неясного генеза у мальчиков в возрасте до 3 лет. Клинические проявления ИМВП у грудных детей и детей раннего возраста могут варьировать от лихорадки до симптомов со стороны желудочно-кишечного тракта (ЖКТ), а также симптомов со стороны верхних и нижних отделов МВП.
Обследование детей с ИМВП необходимо проводить после 2 эпизодов у девочек и 1 эпизода у мальчиков (степень рекомендаций В). Целью обследования является исключение необычной обструкции МВП, пузырно-мочеточникового рефлюкса и функциональных нарушений мочеиспускания, например, при неврологических расстройствах.
Склерозирование почки вследствие хронического пиелонефрита у детей развивается очень рано благодаря комбинации ИМВП, внутрипочечного рефлюкса и ПМР. Иногда склерозирование почки начинается еще внутриутробно и обусловлено ее дисплазией. Несмотря на редкость этого состояния, оно приводит к тяжелым отдаленным последствиям, таким как артериальная гипертензия и хроническая почечная недостаточность.
При выявлении пузырно-мочеточникового рефлюкса (ПМР) показан длительный профилактический прием антибиотиков (степень рекомендаций В). Хирургическая реимплантация или эндоскопическое лечение являются терапией «резерва» для небольшого числа детей с инфекций, возникающей несмотря на проведение антибиотикопрофилактики (степень рекомендаций В).
При лечении ИМВП у детей не рекомендуется применять короткие курсы терапии, поэтому терапия обычно продолжается 5-7 дней и более (степень рекомендаций А). В тяжелых случаях, сопровождающихся рвотой и дегидратацией, показана госпитализация ребенка и проведение стартовой парентеральной антибактериальной терапии (степень рекомендаций А).
Вводная информация
Мочевыделительная система - самый частый источник инфекции у детей. ИМВП являются наиболее распространенными бактериальными инфекциями у детей в возрасте до 2 лет [1] (уровень доказательности 2a). Исходы ИМВП обычно благоприятные, но на первом году жизни они могут прогрессировать в склероз почек, особенно при наличии врожденных аномалий МВП. Отдаленные последствия, связанные со склерозом почек, включают в себя артериальную гипертензию, протеинурию, нарушение функции почек вплоть до развития хронической почечной недостаточности, требующей проведения диализа у значительного числа взрослых [2] (уровень доказательности 2a).
Риск ИМВП в течение первых 10 лет жизни составляет 1 % для мальчиков и 3 % для девочек [3]. В школьном возрасте предположительно 5 % девочек и до 0,5 % мальчиков переносят как минимум 1 эпизод ИМВП за период обучения в школе. Частота развития ИМВП различается у детей до 3 мес, когда эти инфекции более распространены у мальчиков. Частота бессимптомной бактериурии составляет
0,7-3,4 % у новорожденных, 0,7—1,3 % — у детей до 3 мес и 0,2-0,8 % — у мальчиков и девочек дошкольного возраста [3]. Распространенность бактериурии, сопровождающейся клиническими симптомами, составляет 0,14 % у новорожденных и затем увеличивается до 0,7 % у мальчиков и до 2,8 % у девочек в возрасте до 6 мес. Общая частота рецидивов ИМВП в неонатальном периоде составляет 25 % [3, 4].
Этиология
Наиболее частыми возбудителями ИМВП у детей являются грамотрицательные бактерии, главным образом кишечной группы. Из них E. coli (кишечная палочка) ответственна за развитие 90 % всех эпизодов ИМВП [5].
Грамположительные микроорганизмы (в частности, энтерококки и стафилококки) выделяются в 5—7 % случаев.
Нозокомиальные инфекции характеризуются широким спектром агрессивных возбудителей, таких как Klebsiella, Serratia и Pseudomonas spp.
Стрептококки групп А и В относительно часто встречаются среди возбудителей ИМВП у новорожденных [6]. В настоящее время наблюдается тенденция к более частому выделению S. saprophyticus при ИМВП у детей, хотя роль этого микроорганизма остается спорной [7].
Патогенез и факторы риска
МВП представляют собой стерильное пространство с непроницаемой внутренней выстилкой. Самым частым механизмом развития инфекций является ретроградное восходящее проникновение возбудителей. Нозокомиальное инфицирование и вовлечение МВП в процесс в результате системной инфекции встречаются реже [8].
Наиболее частыми причинами ИМВП у детей служат обструкция и функциональные нарушения МВП. Фимоз является фактором, предрасполагающим к развитию ИМВП [9, 10] (уровень доказательности 2а). Энтеробактерии кишечной флоры колонизируют препуциальный мешок, поверхность желез и дистальный отдел уретры. Среди этих микроорганизмов присутствуют штаммы E. coli, экспрессирующие Р-фимбрии, при помощи которых бактерии прикрепляются к внутреннему слою кожи крайней плоти и клеткам уроэпителия [11].
Развитию ИМВП может способствовать широкий спектр врожденных аномалий, приводящих к обструкции МВП, таких как клапаны уретры, обструкции лоханочно-мочеточникового сегмента или необструктивному застою мочи (например, при синдроме «сливового живота», ПМР). К не менее значимым причинам ИМВП относятся сращение половых губ и хронический запор [7].
Функциональные нарушения мочеиспускания у практически здоровых детей могут сопровождаться редким опорожнением мочевого пузыря, которому способствуют такие привычные действия, как сидение со скрещенными ногами и сидение на корточках [12]. Нейрогенная дисфункция мочевого пузыря (при spina bifida, диссинергии сфинктера мочевого пузыря и др.) может способствовать скоплению остаточной мочи в мочевом пузыре и вторичному ПМР [4].
Связь между поражением почек и ИМВП является противоречивой. Механизм развития ИМВП при обструктивной нефропатии очевиден, однако более тонкие изменения в почках развиваются при наличии ПМР.
Для поражения почек определенно необходимы такие компоненты, как пузырно-мочеточниковый рефлюкс, внутрипочечный рефлюкс и инфекция мочевыводящих путей. Все эти факторы должны воздействовать одновременно в раннем детском возрасте, когда растущая почка особенно чувствительна к инфекциям паренхимы.
В более позднем возрасте наличие бактериурии, по-видимому, не имеет отношения к прогрессированию существующих или появлению новых склеротических изменений в почках. Еще одним вмешивающимся фактором является то, что многие так называемые «почечные рубцы» представляют собой дисплазию почечной ткани, которая развивается еще во внутриутробном периоде [13].
Проявления и симптомы
Симптомы ИМВП у детей неспецифичны и могут отличаться в зависимости от возраста и степени тяжести заболевания. Эпидидимоорхит встречается крайне редко. При наличии у мальчика боли и признаков воспаления в мошонке следует заподозрить перекрут яичка.
Симптомы ИМВП у новорожденных могут быть неспецифическими и не иметь четкой локализации. У маленьких детей ИМВП могут проявляться симптомами со стороны ЖКТ, такими как рвота и диарея. В первые несколько недель жизни у 13,6 % детей с лихорадкой имеет место ИМВП [14]. Редко ИМВП может проявляться септическим шоком.
У маленьких детей признаки ИМВП могут быть стертыми, но позднее, начиная с 2-летнего возраста, проявляются учащенным мочеиспусканием, дизурией, болью в надлобковой области, животе или спине с/без повышения температуры тела.
Классификация
ИМВП у детей можно классифицировать как первый эпизод или рецидив, а также по степени тяжести (нетяжелые и тяжелые).
Рецидивирующие инфекции мочевыводящих путей подразделяют на 3 группы [8]:
Неразрешившаяся инфекция: субоптимальные дозы антибиотиков, несоблюдение режима лечения, синдром мальабсорбции, резистентные возбудители.
Персистирование возбудителя: может быть обусловлено формированием очага персистирующей инфекции в МВП; может потребоваться хирургическое вмешательство или медикаментозное лечение для устранения нарушенной функции.Реинфекция: каждый эпизод представляет собой новое инфицирование представителями микрофлоры периуретрального пространства, промежности или прямой кишки. С клинической точки зрения ИМВП следует разделять на нетяжелые и тяжелые, поскольку тяжесть симптомов до известной степени определяет срочность и объем необходимого обследования и лечения.

http://bladderexstrophy.ru/pic01/20141121_pic006.jpg
Тяжелые инфекции мочевыводящих путей
Для тяжелых ИМВП характерны наличие лихорадки (> 39 °С), плохое общее самочувствие, упорная рвота и умеренная или выраженная дегидратация.
Нетяжелые инфекции мочевыводящих путей
У ребенка с нетяжелой ИМВП может наблюдаться только небольшое повышение температуры тела, при этом он может пить и принимать лекарства внутрь. Дегидратация отсутствует или выражена незначительно. Ребенок готов соблюдать режим лечения. При предполагаемой низкой комплаентности его следует вести как ребенка с тяжелой ИМВП.
Диагностика
Физикальное обследование
Необходимо провести обследование на предмет выявления фимоза, сращения половых губ, признаков пиелонефрита, эпидидимоорхита и spina bifida (например, пигментное пятно с волосами в области крестца). Отсутствие лихорадки не исключает наличие инфекционного процесса.
Лабораторные тесты
Для подтверждения диагноза ИМВП у детей необходимо получение положительного результата культурального исследования мочи [8, 15]. Для бактериологического исследования образец мочи следует собирать с соблюдением соответствующих условий [16]. Положительным результатом считается наличие в моче уропатогена в концентрации > 105 КОЕ/мл. У детей в возрасте до 4 лет сбор мочи может оказаться затруднительным, поэтому, учитывая наличие высокого риска контаминации образца, предлагаются различные методы взятия материала [17, 18].
Сбор мочи
Надлобковая пункция мочевого пузыря
Надлобковая пункция мочевого пузыря является самым чувствительным методом, даже несмотря на то что моча может быть получена в 23—99 % случаев [8, 18].
Катетеризация мочевого пузыря
Катетеризация мочевого пузыря также является методом с высокой чувствительностью, даже несмотря на существующий риск инфицирования нозокомиальными микроорганизмами [8, 19].
Полиэтиленовый пакет, прикрепляемый к половым органам
В проспективных исследованиях была выявлена высокая частота ложноположительных результатов при этом методе сбора мочи, составлявшая от 85 до 99 % [8, 18]. Метод может быть полезным при отрицательном результате культурального исследования [8, 18], при этом прогностическая ценность положительного результата составляет 15 % [16]. Наилучшими способами получения образца мочи у детей до 2 лет являются надлобковая пункция и катетеризация мочевого пузыря. У детей старшего возраста, которые способны контролировать работу наружного сфинктера, возможным и надежным способом получения материала для культурального исследования является сбор СПМ [18].
Количественная оценка бактериурии
Конечное количество бактерий в моче напрямую зависит от метода ее сбора, диуреза, условий хранения и транспортировки образца [15]. Клинически значимой бактериурией по-прежнему считается количество уропатогена > 105 КОЕ/мл и зависит от клинической ситуации [15, 17].
Наличие пиурии (> 5 лейкоцитов в поле зрения) и бактериурии в свежем образце мочи надежно подтверждает клинический диагноз ИМВП [17].
У мальчиков при получении образца мочи с помощью катетеризации мочевого пузыря положительным результатом культурального исследования считается количество уропатогена > 104 КОЕ/мл.
Несмотря на то что в исследовании Hoberan [20] в 65 % случаев микроорганизмы выделялись в количестве от 104 до 5 х 104 КОЕ/мл, однако все равно выявлялись микробные ассоциации, свидетельствующие о контаминации образцов. В таких случаях целесообразно повторно провести бактериологическое исследование мочи или оценить наличие других признаков ИМВП, таких как пиурия, нитриты в моче или другие биохимические маркеры [15]. Выделение уропатогена в концентрации > 105 КОЕ/мл из образца СПМ или полиэтиленового пакета считается положительным результатом бактериологического исследования [16] (табл. 2).
Другие биохимические маркеры
Наличие некоторых биохимических маркеров в образце мочи позволяет установить диагноз ИМВП [8]. Наиболее часто используемыми маркерами являются нитриты и эстераза лейкоцитов, которые обычно определяются вместе при помощи тест-полосок.
Нитриты
Нитриты являются продуктом разрушения нитратов в результате метаболизма бактерий, в частности грамотрицательных микроорганизмов. При ИМВП, вызванных грамположительными бактериями, этот тест может быть отрицательным [8, 16]. Тест на определение нитритов имеет следующие ограничения:
не все уропатогены восстанавливают нитраты до нитритов (например, P. aeruginosa, энтерококки);
даже при наличии нитритпродуцирующих микроорганизмов результаты теста могут быть отрицательными из-за короткого времени нахождения мочи в мочевом пузыре при высоком диурезе и разведении мочи (например, у новорожденных). Тест на определение в моче нитритов обладает небольшой чувствительностью — всего 45—60 %, но при этом характеризуется высокой специфичностью — 85—98 % [8, 17, 21].
Лейкоцитарная эстераза
Эстераза лейкоцитов вырабатывается лейкоцитами. Тест на определение эстеразы лейкоцитов обладает чувствительностью 48—86 % и специфичностью 17—93 % [8, 17, 20, 21].
Комбинация тестов на определение нитритов и эстеразы лейкоцитов повышает чувствительность и специфичность, однако сопряжена с риском получения ложноположительных результатов [21]. Анализ мочи с помощью тест-полосок позволяет быстро и надежно исключить ИМВП при условии отрицательных результатах тестов на определение нитритов и эстеразы лейкоцитов. При положительных результатах последних 2 тестов их лучше подтвердить в сочетании с клиническими симптомами и данными других тестов [17, 21].
Бактериурия без пиурии может обнаруживаться в следующих случаях:
при бактериальной контаминации
при колонизации (бессимптомная бактериурия)
при получении образца мочи еще до развития воспалительной реакции.
В таких случаях с целью уточнения ситуации рекомендуется повторить анализ мочи через 24 ч. Даже у детей с лихорадкой и положительными результатами культурального исследования мочи отсутствие пиурии может поставить под сомнение диагноз ИМВП. В таких случаях следует предположить бессимптомную бактериурию на фоне сопутствующего очага инфекции, обуславливающего лихорадку.Бактериурия без пиурии выявляется примерно в 0,5 % образцов мочи. Этот показатель очень четко соответствует предполагаемой частоте бессимптомной бактериурии у детей [20, 22] (уровень доказательности 2a).
Пиурия без бактериурии может быть обусловлена:
неадекватной антимикробной терапией ИМВП
уролитиазом или инородным телом
инфекциями, вызванными Mycobacterium tuberculosis или другими «привередливыми» микроорганизмами, например Chlamydia trachomatis.
Таким образом, ни бактериурия, ни пиурия не могут считаться надежными показателями для установления диагноза ИМВП или его исключения. На их интерпретацию могут оказывать влияние другие факторы, такие как степень обезвоживания, метод сбора мочи, способ центрифугирования, объем для растворения клеточного осадка и субъективность оценки [23]. Тем не менее, по данным Landau et al. [24], пиурия у детей с лихорадкой является признаком острого пиелонефрита. Учитывая все эти обстоятельства, у новорожденных и детей в возрасте до 6 мес каждый из указанных тестов (пиурия, бактериурия или тест на определение нитритов) в отдельности при ИМВП имеет небольшое диагностическое значение [25, 26] (уровень доказательности 3).
Напротив, прогностическая ценность положительного результата микроскопии, окрашенного по Граму мазка, в сочетании с пиурией составляет 85 % [20] (уровень доказательности 2b). У детей старшего возраста пиурия в сочетании с положительным тестом на определение нитритов служит более надежным показателем для диагностики ИМВП. При этом прогностическая ценность положительного результата составляет 98 de_ Обнаружение > 10 лейкоцитов/мм3 и > 5 х 104 КОЕ/мл в образце мочи, полученном при катетеризации мочевого пузыря, при сочетании тестов на бактериурию и пиурию у детей с лихорадкой, имеет диагностическое значение при ИМВП, что позволяет провести дифференциальную диагностику между инфекцией и контаминацией [20, 25].
С-реактивный белок
Несмотря на неспецифичность, определение С-реактивного белка у детей с лихорадкой и бактериурией помогает провести дифференциальную диагностику между пиелонефритом и другими причинами бакте-риурии. Клинически значимым считается повышение этого показателя > 20 мкг/мл.
N-ацетил-β-глюкозаминидаза мочи
Данный показатель является маркером повреждения почечных канальцев. Уровень N-ацетил-β-глюкозаминидазы повышается при ИМВП, сопровождающейся лихорадкой, и может быть надежным тестом для диагностики ИМВП, несмотря на то что он также повышается и при ПМР [27].
Интерлейкин-6
Клиническое применение определения в моче уровня интерлейкина-6 находится на стадии изучения [28].
Методы визуализации мочевыводящих путей
Чтобы считаться «золотым стандартом», метод визуализации должен быть экономически оправданным, безболезненным, безопасным, с минимальным или отсутствием облучения и способным выявлять любые значимые структурные аномалии. Существующие методы визуализации не соответствуют всем указанным требованиям.
Ультразвуковое исследование
Благодаря своей безопасности, быстроте проведения и высокой точности УЗИ широко используется у детей для выявления структуры и размеров паренхимы и собирательной системы почек [29]. Этот метод исследования является субъективным (не дает информации о функции почек) и тем самым зависит от квалификации выполняющего его специалиста. Тем не менее УЗИ позволяет выявлять склеротические изменения в почках, хотя и не так хорошо, как сканирование с димеркаптоянтарной кислотой, меченой технецием (ДМЯК-Тс99m) - синоним: технеций99m DMSA (примечание администрации сайта) [29, 30] (уровень доказательности 2a). Показано, что УЗИ является очень чувствительным методом исследования, поэтому экскреторная урография должна быть методом «резерва» и применяться только в тех случаях, когда полученные при УЗИ снимки требуют уточнений структуры [31] (уровень доказательности 2a).
Радионуклидные исследования
Технеций99m DMSA представляет собой радиофармпрепарат, который связывается с базальной мембраной клеток проксимальных почечных канальцев; половина введенной дозы определяется в корковом веществе почек спустя 6 ч. Этот метод позволяет выявить функционирующую почечную ткань и поставить точный диагноз склероза коркового вещества (участки сниженного накопления радиофармпрепарата укажут на потерю функции). ИМВП влияет на захват технеция99m DMSA клетками проксимальных почечных канальцев, что выглядит как очаговые дефекты накопления в почечной паренхиме. Дефекты накопления в форме звезды в паренхиме почек могут указывать на острый пиелонефрит. Очаговые дефекты накопления в корковом веществе обычно говорят о хроническом поражении или участке склероза [32—34] (уровень доказательности 2a).
Очаги склероза или равномерное снижение накопления (уменьшение почечной паренхимы) при сканировании с технецием99m DMSA принято считать признаком ПМР (рефлюкс-нефропатия) [35, 36]. Тем не менее Rushton et al. [37] утверждают, что выраженные склеротические изменения в почках могут развиваться независимо от наличия/отсутствия ПМР. По данным Ransley и Ridson [38], сканирование с технецием99m DMSA обладает 100 % специфичностью и 80 % чувствительностью при выявляении очагов склероза.
Сканирование с технецием99m DMSA может помогать в ранней диагностике острого пиелонефрита. На первой неделе заболевания характерные изменения обнаруживаются приблизительно у 50—85 % детей. Минимальные дефекты накопления в паренхиме, т. е. очаги незначительно сниженной функциональной активности почечной ткани, могут исчезать после проведения антимикробной терапии [39, 40]. Однако дефекты накопления, сохраняющиеся > 5 мес, следует считать очагами склероза [41] (уровень доказательности 2a).
Сканирование с технецием99m DMSA считается более чувствительным методом выявления склеротических изменений в почках, чем экскреторная урография или УЗИ [42—45]. Вопрос о том, можно ли заменить УЗИ радионуклидным сканированием в качестве метода первичной диагностики ИМВП у детей, остается спорным [46, 47].
Цистография
Традиционная микционная цистография
Микционная цистография (МЦ) является наиболее широко используемым методом рентгенологического исследования нижних отделов МВП, особенно при наличии ПМР. Этот метод считается обязательным в плане обследования у детей до 1 года с ИМВП. Основными недостатками МЦ служат риск инфицирования, необходимость ретроградного заполнения мочевого пузыря и возможное неблагоприятное влияние лучевой нагрузки на ребенка [48].
В последние годы с целью уменьшения такой нагрузки для диагностики ПМР у девочек стали применять специально разработанный вариант МЦ с использованием низкой дозы флюоресцирующих красителей [49]. МЦ является обязательным методом исследования у детей с ИМВП и лихорадкой, даже при отсутствии изменений на УЗИ, только после купирования атаки пиелонефрита, при повторной плановой госпитализации. У 23 % таких детей выявляют ПМР [50].
Радионуклидная (непрямая) цистография
Этот метод исследования является частью динамической нефросцинтиграфии и проводится путем увеличения периода сканирования после введения меченого технецием диэтилентриаминпентаацетата (ДТПА) или меркаптоацетилтриглицина (МАГ-3). Благодаря меньшей лучевой нагрузке такой метод представляет собой хорошую альтернативу традиционной цистографии, особенно при наблюдении пациентов с рефлюксом. Недостатком метода является низкое разрешение снимков и затруднения при выявлении нарушений со стороны нижних отделов МВП [51, 52].
Ультразвуковое исследование мочевого пузыря
УЗИ мочевого пузыря с использованием контрастных веществ, проводимое во время мочеиспускания, было предложено как метод диагностики ПМР, не сопровождающийся лучевой нагрузкой [47, 52]. Для определения роли этого нового метода в диагностике ИМВП необходимо проведение дополнительных исследований.
Дополнительные методы визуализации
Экскреторная урография остается ценным методом оценки состояния МВП у детей, однако ее применение при ИМВП остается спорным, кроме тех случаев, когда предыдущее обследование выявило какие-либо изменения, требующие дальнейшего исследования. Основными недостатками этого метода у детей служат риск развития нежелательных лекарственных реакций, связанных с применением контрастного вещества, и лучевая нагрузка [53]. По мере технического усовершенствования КТ и МРТ роль экскреторной урографии снижается [54], однако показания для применения этих методов при ИМВП пока тоже остаются ограниченными.
Уродинамическое исследование
При подозрении на нарушения мочеиспускания (например, недержание мочи, наличие остаточной мочи, утолщение стенок мочевого пузыря) следует рассмотреть вопрос о проведении уродинамического исследования с урофлоуметрией, видеоцистометрией, включая исследования по измерению давления потока и электромиографию.
План обследования
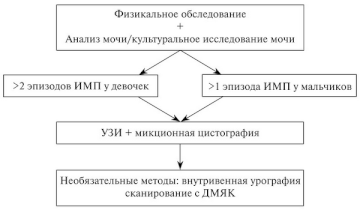
Маловероятно, что скрининг грудных детей на бессимптомную бактериурию будет способствовать предотвращению склеротических изменений в почках, связанных с пиелонефритом, поскольку эти изменения обычно формируются в очень раннем возрасте. Лишь небольшая часть детей с ИМВП имеет сопутствующие урологические нарушения, однако их наличие может способствовать значительной заболеваемости. Таким образом, максимум после 2-го эпизода ИМВП у девочек и первого эпизода ИМВП у мальчиков необходимо проводить комплексное обследование (рис. 1.), однако это не относится к случаям бессимптомной бактериурии [51—58]. Необходимость проведения сканирования с ДТПА/ МАГ-3 определяется результатами УЗИ, в частности при подозрении на наличие обструкции.
[center]
http://bladderexstrophy.ru/pic01/2012-08-20-imvp-plan.gif
Рис. 1. План обследования ребенка с ИМВП[/center]
Лечение
Лечение ИМВП у детей имеет 4 основные цели.
1. Устранение симптомов заболевания и эрадикация возбудителя при остром эпизоде.
2. Профилактика склеротических изменений в почках.
3. Профилактика рецидивов ИМВП.
4. Коррекция сопутствующих урологических нарушений.
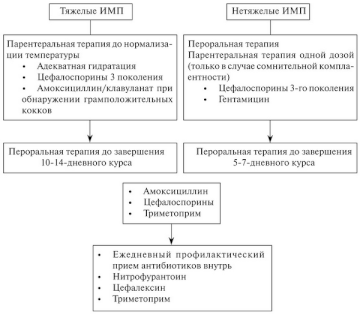
Тяжелые инфекции мочевыводящих путей
При тяжелых ИМВП требуется проведение адекватной инфузионной и антимикробной терапии, предпочтительно, цефалоспоринами III поколения. В случае обнаружения при микроскопии окрашенного по Граму мазка, грамположительных микроорганизмов следует применять аминогликозиды в комбинации с ампициллином или амоксициллин/клавуланатом [59] (уровень доказательности 2a). Стартовая антимикробная терапия должна быть эмпирической, однако по возможности она должна корректироваться после получения результатов культурального исследования. У пациентов с аллергией на цефалоспорины можно применять азтреонам или гентамицин. При необходимости введения аминогликозидов требуется контролировать их уровень в сыворотке крови с целью коррекции дозы. Следует избегать применения хлорамфеникола, сульфаниламидов, тетрациклинов, рифампицина, амфотерицина В и хинолонов. Также нельзя использовать цефтриаксон из-за его способности вызывать желтуху.
У детей старшего возраста можно применять широкий спектр антибиотиков, за исключением тетрациклинов (из-за возможности окрашивания зубной эмали). Фторхинолоны могут оказывать хондротоксический эффект [58], однако при необходимости их можно применять в качестве препаратов 2-й линии при тяжелых инфекциях, поскольку нежелательные явления со стороны костно-мышечной системы выражены умеренно и носят временный характер [60, 61]. В первые 24—36 ч следует проводить парентеральную терапию. После того как у ребенка нормализуется температура тела и он сможет самостоятельно пить, его следует перевести на пероральный прием препаратов для завершения 10—14-дневного курса лечения, которое можно продолжать амбулаторно. Преимуществами такой тактики являются менее выраженное психологическое влияние на ребенка и большее удобство для всей семьи. Кроме этого, перевод на амбулаторное лечение снижает его общую стоимость, хорошо переносится и предотвращает присоединение оппортунистических инфекций [20].
Предпочтительными пероральными препаратами являются: триметоприм (TMP), ко-тримоксазол (TMP/сульфаметоксазол), пероральные цефалоспорины или амоксициллин/клавуланат. Применение TMP постепенно уменьшается из-за роста резистентности микроорганизмов к этому антибиотику.
У детей в возрасте до 3 лет, которым трудно принимать лекарства перорально, целесообразным считается продолжение парентеральной терапии в течение 7—10 дней, что дает такие же результаты, что и пероральная терапия [62].
При наличии выраженных нарушений со стороны МВП (например, ПМР, обструкция) следует решить вопрос о проведении соответствующего урологического вмешательства. При выявлении склеротических изменений в почках требуется тщательное наблюдение пациента педиатром для своевременного обнаружения таких последствий, как артериальная гипертензия, нарушение функции почек и рецидивирующие ИМВП.
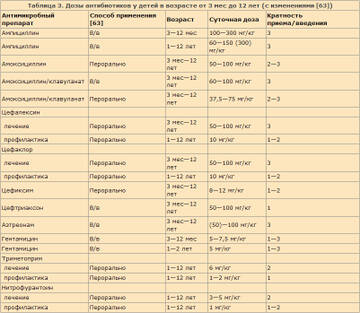
Алгоритм лечения детей с ИМВП, сопровождающейся лихорадкой, представлен на рис. 2; режимы дозирования антибиотиков приведены в табл. 3 [63].
Нетяжелые инфекции мочевыводящих путей
Нетяжелые ИМВП у детей считаются инфекциями невысокого риска. В этих случаях рекомендуется эмпирическая пероральная терапия TMP, пероральными цефалоспоринами или амоксициллином/клавуланатом в зависимости от локальных данных по резистентности. Длительность пероральной терапии неосложненных ИМВП должна составлять 5—7 дней [64, 65] (уровень доказательности 1b). В случае сомнительной комплаентности у ребенка без нарушений со стороны МВП может использоваться однократное парентеральное введение антибиотика [66] (уровень доказательности 2a). При недостаточной эффективности лечения или развитии осложнений показана госпитализация ребенка для проведения парентеральной терапии [67].
Профилактика
При наличии повышенного риска развития пиелонефрита (например, при ПМР) и рецидивирующих ИМВП рекомендуется проводить профилактику низкими дозами антибиотиков [68, 69] (уровень доказательности 2а). Регулярный прием антибиотиков в низкой дозе также может применяться после острого эпизода ИМВП до завершения диагностического обследования.
Наиболее эффективными препаратами для профилактики являются: нитрофурантоин (нитрофурантоин не накапливается в паренхиме почек, поэтому не может служить средством для профилактики развития пиелонефрита). Однако, создавая высокую концентрацию в моче и обладая достаточно высокой активностью по отношению к кишечной палочке, препарат может широко применяться для профилактики рецидивов цистита, который в свою очередь способствует возникновению нарушения замыкательной функции устьев мочеточника (за счет развития склеротических изменений в стенке мочевого пузыря) и формированию или прогрессированию ПМР. Следовательно, применение нитрофурантоина для профилактики рецидивирующего цистита косвенно способствует предотвращению развития или прогрессирования пиелонефрита (прим. ред. русского перевода), TMP, цефалексин и цефаклор [68].
Последнее обновление данных рекомендаций EAU - апрель 2011 г.
- Подпись автора
Не спрашивай, по ком звонит колокол: он звонит по тебе © (Джон Донн)